Dimerisierung
Die Dimerisation (synonym Dimerisierung) ist die Zusammenlagerung zweier Einheiten (Monomere genannt),[1] das Produkt wird Dimer genannt.
Schließen sich drei Einheiten (Moleküle oder Atome) zusammen, so spricht man von Trimerisation, bei vier Einheiten von Tetramerisation. Die entstehenden Moleküle nennt man Trimere, Tetramere usw. Dimerisation ist eine Sonderform der Polymerisation.
di- ist die griechische Vorsilbe für zwei(fach), tri die Vorsilbe für drei(fach), tetra für vier(fach).
Chemie
[Bearbeiten | Quelltext bearbeiten]In der Chemie bezeichnet Dimerisation die Zusammenlagerung zweier identischer Einheiten:
- A + A → A2
Dabei kann es sich um Atome oder Moleküle handeln. Ein Beispiel ist die photokatalysierte Dimerisation von Anthracen:
Bei Polymerisationen kann es als Nebenreaktion ebenfalls zur Dimerisation kommen:
- Stickstoffmonoxid (NO) kann im flüssigen oder festen Zustand zu N2O2 dimerisieren.
- Das braune Stickstoffdioxid (NO2) dimerisiert unter erhöhtem Druck zum farblosen Distickstofftetroxid (N2O4).[2]
- Zwei Bromradikale dimerisieren zu molekularem Brom (Br2)
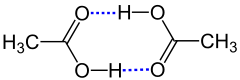
Man spricht auch von Dimerisation, wenn das Dimer nur durch Wasserstoffbrücken zusammengehalten wird, wie bei der Dimerisation von Carbonsäuren, z. B. Essigsäure:[1]
Nicht nur Moleküle, sondern auch Radikale können dimerisieren, z. B. zwei Methylradikale (CH3•):
- CH3• + CH3• → H3C-CH3
Obwohl die Summenformel eines Dimers strenggenommen die Verdopplung der Monomer-Summenformel sein sollte, bezeichnet man im erweiterten Sinne auch solche Verbindungen als Dimere, die etwa durch Kondensation zweier Monomere entstehen:
- Maltose ist ein Homodimer aus zwei Glucosemolekülen.
- Rohrzucker (Saccharose) ist ein Heterodimer aus einem Glucose- und einem Fructosemolekül.
- Glycylglycin ist das Homodimer, das durch Peptidknüpfung aus zwei Glycinmolekülen resultiert.
Bei den drei letztgenannten Beispielen ist die Summenformel des Dimers gegenüber der Summe der Summenformeln der Monomere jeweils um zwei Wasserstoffatome und ein Sauerstoffatom verringert. Bei diesen Dimerisierungen entsteht also Wasser (H2O) als Nebenprodukt.
Biochemie
[Bearbeiten | Quelltext bearbeiten]Bei der Dimerisation von Biomolekülen entsteht ein Homodimer, wenn sich zwei gleichartige Monomere zusammenschließen (Homodimerisierung) oder ein Heterodimer, wenn es sich um zwei unterschiedliche Monomere handelt (Heterodimerisierung). Die bei einer Dimerisierung von Proteinen wirkenden Kräfte beruhen überwiegend auf nicht-kovalenten Wechselwirkungen, wie Van-der-Waals-Kräften und Wasserstoffbrückenbindungen, elektrostatischen Wechselwirkungen und hydrophoben Effekten der Aminosäurereste oberflächennaher Proteindomänen zwischen den beteiligten Proteinen. Beispielsweise dimerisieren die Bestandteile eines Antikörpers, eine leichte und eine schwere Kette. Dieses Heterodimer verbindet sich (dimerisiert) anschließend wiederum mit einem zweiten, identisch zusammengesetzten Heterodimer zum Antikörper.
Bei einer chemisch induzierten Dimerisierung verwendet man verschiedene niedermolekulare Verbindungen zur Einleitung einer Dimerisation von bestimmten Fusionsproteinen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu dimerization. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.D01744 – Version: 2.3.3.
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 299.


